mRNA-1273 = 모더나
2차 또는 3차 백신을 투여했을때
유발된 바이러스 억제 항체는 급증할 것이며
상기도를 감염시키는 바이러스를 억제하기에 충분
항체 수치가 높으면 비감염성 백신의 문제를 해결할 수 있다.
그러나 현실은 항체 수치가 떨어집니다
이유는 백신이 그러한 항체를 생성하도록 자극하는
세포의 수명이 1-2주에 불과하기 때문입니다.
감염으로부터 자신을 보호할 수 있을 만큼
높은 항체 수치는 오래가지 못합니다.
그러나 폐 또는 하기도의 감염 예방은
훨씬 낮은 수준의 항체를 사용합니다.
그래서 백신으로 면역된 사람들의
심각한 질병이나 사망의 비율은 매우 낮습니다.

mRNA-1273 백신을 접종한 NHP의 혈청 및 점막 스파이크 특이적 IgG 수준은 SARS-CoV-2 공격 후 상기도 및 하기도의 바이러스 복제 감소와 반비례했습니다.
(구글 번역)
비인간 영장류에서 SARS-CoV-2에 대한 mRNA-1273 백신 보호의 면역 상관 관계
2021년 9월 17일
보호 기능이 있는 항체 도브테일
면역 보호 상관 관계는 백신 유도 면역원성 및 보호를 측정하는 데 사용되는 임상 종점입니다. Corbett et al. 다양한 면역 반응과 보호 결과를 제공하기 위해 다양한 용량의 mRNA-1273(Moderna) 백신에 대한 비인간 영장류(NHP) 면역 반응을 연구했습니다. 그들은 순환하는 스파이크 단백질-특이 항체가 기도에서 중증 급성 호흡기 증후군 코로나바이러스 2(SARS-CoV-2) 복제에 대한 보호와 상관관계가 있다고 결정했습니다. 수동적으로 전달된 NHP 항체는 햄스터에서 SARS-CoV-2 공격에 대한 보호를 매개하기에 충분했으며, 항체가 기계적 상관관계가 있음을 강조합니다. 하기도 보호를 위해서는 더 낮은 혈청 항체 농도가 필요했으며, 아마도 대부분의 현재 백신이 심각한 하기도 질환에 대해 매우 효과적인 이유를 설명할 수 있을 것입니다. 상기도 감염을 줄이는 데 필요한 더 높은 항체 역치는 전파를 제한하기 위해 부스팅하는 데 잠재적인 영향을 미칩니다.
구조화된 초록
소개
중증급성호흡기증후군 코로나바이러스 2(SARS-CoV-2)에 대한 대량 백신 접종은 COVID-19 전염병을 통제하기 위한 가장 효율적인 공중 보건 개입을 제공합니다. 두 가지 mRNA 기반 백신인 Moderna의 mRNA-1273과 Pfizer/BioNTech의 BNT162b2는 모두 prefusion-stabilized spike glycoprotein S-2P를 암호화하며, 중간 3상 분석에서 증상이 있는 COVID-19에 대해 >94%의 효능을 보여 현재 투여되고 있습니다. 전 세계적으로. 다른 여러 백신은 3상 시험에서 증상이 있는 COVID-19에 대해 60~80%의 효능을 보였고 많은 후보 백신이 임상 개발 초기 단계에 있습니다. 보호의 면역 상관 관계는 잠재적인 용량 감소를 알리고, 3상 유효성 데이터 대신 다른 백신 후보의 사전 승인을 알리고, 다른 연령대로 사용 적응증을 확장하는 데 사용할 수 있습니다.
이론적 해석
SARS-CoV-2에 대한 백신의 면역원성과 보호를 평가할 때 비인간 영장류(NHP)는 임상 번역에 유용한 모델이었습니다. NHP 타고난 면역 반응과 B 및 T 세포 레퍼토리는 설치류보다 인간과 훨씬 더 유사하여 임상적으로 적용 가능한 백신 용량 및 요법을 사용하여 면역 반응을 평가할 수 있습니다. SARS-CoV-2 감염 후 NHP는 상기도 및 하기도에서 일시적인 바이러스 복제가 있고 폐에서 경증 염증이 있어 인간의 경증 감염의 특징을 재현합니다. 여기에서 우리는 이전 NHP mRNA-1273 백신 연구의 면역원성 및 보호 평가를 용량 감소 연구의 새로운 데이터와 결합하여 사용했습니다. 우리는 체액성 및 세포성 면역의 다중 측정이 항원공격 후 상기도 및 하기도에서 바이러스 복제의 감소와 어떻게 상관관계가 있는지 평가했습니다. 예방 접종 후 기관지 폐포 세척액(BAL)과 비강 면봉액(NS)의 항체를 분석하여 부위별 면역 상관 관계를 평가했습니다. 마지막으로, mRNA로 면역화된 NHP의 면역글로불린 G(IgG)를 고병원성 시리아 햄스터 SARS-CoV-2 공격 모델에서 수동적으로 전달하여 이러한 항체가 보호에 충분한지 여부를 결정했습니다.
결과
NHP는 0주와 4주에 S-2P를 암호화하는 mRNA 백신인 mRNA-1273을 0.3~100㎍ 범위의 용량으로 투여하지 않았거나 투여량을 받지 않았습니다. mRNA-1273 백신 접종은 용량 의존적 방식으로 순환 및 점막 항체 반응을 유발했습니다. S-특이적 IgG를 측정하기 위한 세계 보건 기구 표준을 사용하여, S-결합 역가의 10배 증가는 공격 후 BAL 및 NS에서 바이러스 복제의 ~10배 감소와 연관되었습니다. S-특이성 IgG가 >336 IU/ml인 동물은 BAL 서브게놈 RNA(sgRNA)가 >10,000카피/ml이었으며, S-특이 IgG가 >645IU/ml인 동물은 NS sgRNA가 >100,000카피/스왑이 아니므로 다음과 같습니다. 보호를 위한 임계값으로 선택됩니다. BAL에서 바이러스 복제의 이러한 감소는 폐 조직에서 제한된 염증 및 바이러스 항원 검출과 연관되었습니다. 마침내,
결론
mRNA-1273 백신 유도 항체 반응은 NHP에서 SARS-CoV-2 감염에 대한 보호의 기계적 상관관계입니다. 하기도의 보호는 상기도보다 낮은 혈청 항체 농도에서 달성되었습니다. 이러한 데이터는 부분적으로 심각한 하부 요로 질환에 대한 백신 효능이 가벼운 상부 요로 질환에 대한 백신 효능보다 크다는 일관된 발견을 설명합니다. 이러한 발견은 추가적인 부스팅이 하기도의 심각한 질병에 대한 보호를 유지하고 상부 호흡기에 필요한 면역을 향상시켜 가벼운 감염 및 전염을 제한할 수 있는 방법에 대한 잠재적인 의미를 가지고 있습니다.

mRNA-1273 백신 유도 체액성 면역 반응은 SARS-CoV-2에 대한 방어의 기계적 상관 관계입니다.
mRNA-1273 백신을 접종한 NHP의 혈청 및 점막 스파이크 특이적 IgG 수준은 SARS-CoV-2 공격 후 상기도 및 하기도의 바이러스 복제 감소와 반비례했습니다.
추상적 인
면역 보호 상관관계는 백신 효능에 대한 대리 평가변수로 사용될 수 있습니다. 여기에서 비인간 영장류(NHP)는 백신을 받지 않았거나 mRNA-1273 중증 급성 호흡기 증후군 코로나바이러스 2(SARS-CoV-2) 백신 0.3~100㎍을 투여받았다. mRNA-1273 백신 접종은 용량 의존적 방식으로 순환 및 점막 항체 반응을 유발했습니다. 바이러스 복제는 백신을 접종한 동물에서 SARS-CoV-2 감염 후 기관지폐포 세척액 및 비강 면봉에서 유의하게 감소되었으며 항-S 항체 수준 및 중화 활성과 가장 강한 상관관계가 있었습니다. 상기도에서보다 하기도에서 바이러스 복제의 감소를 위해 더 낮은 항체 수준이 필요했습니다. 순진한 햄스터에 대한 mRNA-1273 유도 면역글로불린 G의 수동 전달은 보호를 매개하기에 충분했습니다. 따라서,
COVID-19의 원인 인자인 중증 급성 호흡기 증후군 코로나바이러스 2(SARS-CoV-2)는 2021년 7월 13일 현재 전 세계적으로 1억 8천만 명 이상의 감염과 4백만 명의 사망을 초래했습니다( 1 ). 대량 백신 접종은 전염병을 통제하기 위한 가장 효율적인 공중 보건 개입을 제공합니다. 두 가지 mRNA 기반 백신인 Moderna의 mRNA-1273과 Pfizer/BioNTech의 BNT162b2는 모두 스파이크 당단백질( 2 , 3 ) 의 안정화된 버전을 생성하며 , 중간 3상 분석에서 증상이 있는 COVID-19에 대해 >94% 효능을 나타냅니다( 4 , 5 ), 현재 전 세계적으로 관리되고 있습니다. 여러 다른 백신이 3상 시험에서 COVID-19에 대해 60~80%의 효능을 보였습니다( 6 , 7), 여러 후보 백신이 임상 개발 초기 단계에 있습니다( 8 ). COVID-19 백신 사용을 최적화하기 위한 중요한 문제는 보호의 면역 상관 관계를 정의하는 것입니다. 이 백신 효능 예측인자는 잠재적 용량 감소를 알리고, 3상 효능 데이터 대신 다른 백신 후보의 사전 승인을 알리고, 사용 적응증을 다른 연령대로 확장하고, 보호 지속성, 추가 백신 접종의 필요성에 대한 통찰력을 제공하는 데 사용할 수 있습니다. 및 보호의 면역 메커니즘( 9 ).
비인간 영장류(NHP) 모델은 여러 백신 후보를 통해 SARS-CoV-2에 대한 면역원성과 보호 효능을 입증하는 데 사용되었습니다( 10 – 13 ). 임상적으로 관련된 용량 요법을 사용하여 NHP에서 mRNA 백신으로 달성된 높은 수준의 보호는 인간 실험의 결과와 유사합니다. 이 모델은 인간에서 경미한 COVID-19의 임상 증상과 유사한 상기도 및 하기도 감염 및 병리를 나타냅니다( 14 ). 1차 감염 후 보호와 관련된 면역 반응이 NHP에서 평가되었지만( 15 ), 인간에게 사용하도록 승인된 COVID-19 백신으로 백신 접종 후 상기도 및 하기도에서 보호의 면역 상관 관계를 구체적으로 정의한 연구는 현재까지 없습니다. .
우리는 이전 NHP mRNA-1273 백신 연구( 13) 혈청 항체가 보호의 면역 상관 관계로 작용한다는 가설을 테스트합니다. 여기에서, 용량 감소 연구에서 체액성 및 세포성 면역의 다중 측정이 항원공격 후 상부 및 하부 기도의 바이러스 복제 감소와 어떻게 상관관계가 있는지 평가했습니다. 항체 분석은 각각 임상 질병 및 전염과 관련된 상관관계를 평가하기 위해 백신 접종 후 기관지폐포 세척액(BAL) 및 비강 세척에 대해 수행되었습니다. 마지막으로, 우리는 동물의 SARS-CoV-2 감염으로부터 보호하기 위해 mRNA-면역화된 NHP로부터 수동적으로 전달된 면역글로불린 G(IgG)의 능력을 입증했습니다. 따라서, 이 연구는 보호의 상관관계로서 스파이크(S)-특이 항체를 묘사하고, 상부 및 하부 기도 바이러스 복제를 제어하는 국소 점막 항체의 능력을 강조하며,
결과
mRNA-1273 백신 접종은 용량 의존적 방식으로 항체 반응을 유도합니다
우리는 이전에 두 용량 그룹에서 SARS-CoV-2 공격에 대한 높은 수준의 보호와 함께 10 또는 100μg의 mRNA-1273으로 백신 접종 후 NHP에서 혈청 항체 반응의 용량 의존성을 입증했습니다(그림 S1A)( 13 ). 동물에게 30μg의 mRNA-1273 백신을 접종한 추가 NHP 연구(그림 S1B)에서 얻은 이러한 면역원성 결과 및 기타 면역원성 결과는 현재 연구에서 mRNA-1273 백신 접종 후 보호의 면역 상관 관계를 평가하기 위한 연구를 설계하는 데 사용되었습니다(그림 S1B). .S1C). 0.3~30μg 범위의 mRNA-1273 용량을 0주와 4주에 표준 임상 요법으로 투여하여 다양한 면역 반응 및 보호 결과를 생성했습니다.
우리는 프라임 후 및 부스트 후 일시적인 혈청 S 특이적 항체 결합, 결합력 및 중화 반응을 먼저 평가했습니다. 이전 보고서( 13 ) 와 일치하는 S-특이적 결합 항체( 2 , 3)는 각 면역 후 기준선보다 증가하여 30㎍의 mRNA-1273으로 면역화한 후 프라임 및 부스트 후 각각 4주까지 7900 및 64,000 중간 상호 종점 역가에 도달했습니다(그림 S2A). 0.3μg 용량을 제외한 모든 용량 그룹에서 부스트 후 S-특이적 결합 항체가 8-10배 증가했으며, 부스팅은 300배 더 많은 S-특이적 항체를 유도했습니다. 부스트는 항체량뿐 아니라 결합력도 S-specific antibody avidity에서 보듯이 부스트 후 0.3㎍ 용량을 제외한 모든 백신군에서 2배 증가했으며 백신군 간에 차이가 없었다(Fig. S2B). ). 우리는 프라임 [30 mg;50 ) = 76]. 이러한 반응은 전 세계적으로 현재 순환하는 많은 변종에서도 발견됩니다. 부스트 투여 그룹 모두 항체이지만 낮은 (0.3 μg의)을 유도하고 중화 ~ 1 로그 증가 10 최고 용량 군 (도. S2C)에서 승압 한 후.
면역 상관 관계 분석을 위해 우리는 부스트 4주 후 SARS-CoV-2 공격 시 수행된 6개의 다른 적격 항체 분석 데이터를 사용했습니다. SARS-CoV-2 감염 완화에 중요한 항 -S-특이성( 그림 1A ) 및 항-수용체 결합 도메인(RBD)( 그림 1B ) 항체는 SARS-CoV-2 감염을 분석하는 데 사용된 동일한 기술로 평가되었습니다. 3상 임상 SARS-CoV-2 백신 시험 및 세계 보건 기구(WHO) 표준에 따라 정의된 국제 단위(IU)로 정규화되었습니다. 결합 항체 역가는 S-특이적 IgG의 경우 각각 0.3 및 100μg에서 중앙값 55~5800IU/ml, RBD-특이적 IgG의 경우 66~10,400IU/ml 범위에서 용량 의존적 방식으로 대조군 동물과 비교하여 증가했습니다. IgG( 도 1, A 및 B). 또한 100㎍과 1㎍의 mRNA-1273을 비교하여 ACE2 결합 억제 중앙값의 용량 의존적 감소가 있었고( 도 1C ), 이 두 용량 그룹 사이의 최대 차이 270배에 도달했습니다. 시험관 내 바이러스 중화 활성은 세 가지 다른 분석을 사용하여 결정되었습니다. 먼저, 렌티바이러스 기반 D614G 슈도바이러스 중화 분석 은 100-㎍ 용량에서 23,000 및 1㎍의 mRNA-1273으로 면역화한 후 49 의 중간 역 ID 50 역가로 중화 활성의 용량 의존적 증가를 나타내었다 ( 도 1D ). . 수포성 구내염 바이러스(VSV) 기반 슈도 바이러스( 그림 1E )와 라이브 바이러스( 그림 1F)) 중화는 용량 의존성의 동일한 유의한 경향을 따랐다. 항체 결합 및 중화 반응의 평가는 서로 높은 상관관계가 있었으며, 이는 mRNA-1273 면역화 및 고역가 S-결합 항체 반응의 유도가 기능적 항체 반응을 예측함을 시사한다( 도 2 ).

그림 1 . mRNA-1273 면역화 후 항체 반응.
( A 내지 F ) 붉은털원숭이를 도 1에 따라 면역화시켰다. PBS(회색) 또는 mRNA-1273이 포함된 S1(0.3μg, 녹색, 1μg, 자주색, 3μg, 주황색, 10μg, 파란색, 30μg, 분홍색, 100μg, 빨간색). 부스트 4주 후, 공격 직전에 수집된 혈청을 다중 어레이 ELISA에 의해 SARS-CoV-2 S-특이적(A) 및 RBD-특이적(B) IgG, RBD에 대한 ACE2 결합 억제(C), SARS에 대해 평가했습니다. -CoV-2 렌티바이러스 기반 가성바이러스 중화(D), SARS-CoV-2 VSV 기반 가성바이러스 중화(E), SARS-CoV-2 EHC-83E 초점 감소 중화(F). ( G ~ J) BAL[(G) 및 (I)] 및 부스트 후 2주에 수집된 비강 세척제[(H) 및 (J)]는 SARS-CoV-2 S-특이적 IgG[(G)에서 (H)]에 대해 평가되었으며 다중 어레이 ELISA에 의한 IgA [(I) ~ (J)]. 사각형은 이전 실험(S1A, VRC-20-857.1, S1B, VRC-20-857.2)에서 NHP를 나타내고 원은 실험 S1C, VRC-20-857.4에서 개별 NHP를 나타냅니다. 상자와 가로 막대는 각각 사분위수 범위(IQR)와 중앙값을 나타냅니다. 수염 끝점은 최대값 및 최소값과 같습니다. 점선은 해당되는 경우 검출의 분석 한계를 나타냅니다. NT, 테스트되지 않음. 모든 측정값은 Spearman의 상관관계 테스트에 의해 결정된 바와 같이 용량과 유의한 상관관계가 있었습니다( P < 0.0001).
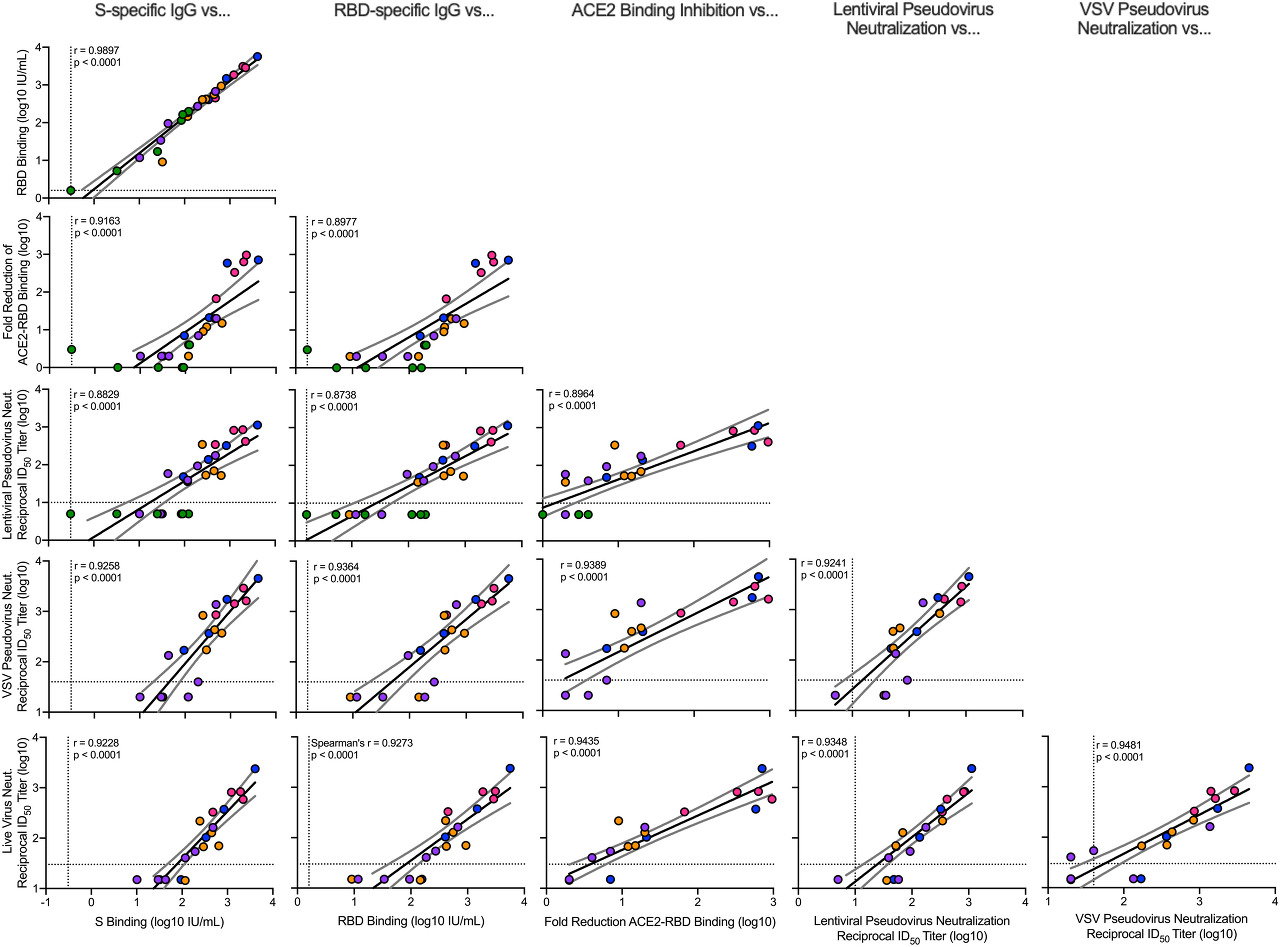
그림 2 . 체액성 항체 분석의 상관관계.
붉은털 원숭이는 그림에 따라 면역화되었습니다. S1C. 플롯은 부스트 후 4주에 SARS-CoV-2 S-특이적 IgG, RBD-특이적 IgG, ACE2-결합 억제, 렌티바이러스 기반 슈도바이러스 중화, VSV 기반 슈도바이러스 중화 및 EHC-83E 초점 감소 중화 간의 상관관계를 보여줍니다. 원은 개별 NHP를 나타내고, 색상은 그림에 정의된 mRNA-1273 용량을 나타냅니다. S1C. 점선은 검출의 분석 한계를 나타냅니다. 검은색과 회색 선은 각각 선형 회귀와 95% 신뢰 구간을 나타냅니다. r 은 Spearman의 상관 계수이고 P 는 해당 P 값입니다.
우려되는 SAR-CoV-2 변이체의 순환 증가를 감안할 때, 그 중 일부는 이전에 SARS-CoV-2에 감염된 피험자의 백신 유도 혈청 및 회복기 혈청에 대한 중화 민감도가 크게 감소한 것으로 나타났습니다( 16 – 20 ). mRNA-1273 면역 NHP 혈청이 우려되는 두 가지 다른 SAR-CoV-2 변이체를 중화시키는 능력. 전염성 이 높고 이전에 전 세계적으로 순환한( 22 ) 알파(B.1.1.7) 변이체( 21 ) 의 생 바이러스 중화는 D614G(그림 S3A)에 비해 눈에 띄게 감소하지 않았습니다. 베타(B.1.351) 변이체는 RBD 및 NTD에 다중 돌연변이를 포함하고 백신 유도 혈청에 의한 중화의 가장 큰 감소를 나타내는 것으로 보고되었습니다(도 16 , 23 , 24 ), 100-㎍ 용량 그룹에서 D614G와 비교하여 9배 감소를 나타내었다. 30 또는 100μg의 mRNA-1273으로 면역화된 동물 12마리 중 9마리는 상호 ID 50 역가가 >100인 반면, 10μg 용량 그룹의 동물 4마리 중 1마리만이 베타 변이체에 대해 검출 가능한 중화 활성을 보였습니다(그림 S3B). mRNA-1273 유도 항체의 베타 중화 능력 감소는 30 또는 100μg의 용량을 사용하여 NHP와 인간에서 이전에 보여진 것을 반영합니다( 16 , 20 ). 그러나 이러한 데이터는 mRNA-1273 용량이 베타 변이체에 대한 중화 항체를 유도하는 데 중대한 영향을 미칠 수 있음을 추가로 시사합니다.
mRNA-1273 예방 접종은 상부 및 하부기도 항체를 유도합니다
감염 부위의 보호 상관관계에 대한 추가 면역 데이터를 제공하기 위해, 부스트 후 2주에 각각 BAL 및 비강 세척 샘플에서 상기도 및 상기도의 항체 반응을 평가했습니다. mRNA-1273의 2회 투여 후 BAL 및 비강 세척 S-특이적 IgG 및 IgA에서 투여량 의존적 증가가 있었다( 도 1, G에서 J ). 0.3 및 30㎍의 mRNA-1273 후 BAL S-특이적 IgG 수준은 중앙값 110 내지 280,000 곡선 아래 면적(AUC)의 범위였다( 도 1G ). 비강 세척 S-특이적 IgG 역가는 86 내지 142,200 AUC 범위였다( 도 1H ). S-특이 IgA에 대한 용량 의존적 경향은 30μg의 mRNA-1273이 BAL에서 1400 및 21,300 AUC IgA를 유도한 낮은 수준에서 유사했지만( 그림 1I ) 비강 세척( 도 1I )도 1j ), 각각. 또한, 상기도 및 하기도 항체 반응은 서로 및 S-특이적 IgG 및 혈청 중화 활성과 상관관계가 있었다. 한 가지 예외는 BAL 및 비강 세척 S-특이 IgA와 상관관계가 없다는 것이었습니다(그림 S4). 따라서 mRNA-1273 백신 접종은 상기도 및 하기도 모두에서 S-특이적 IgG 및 IgA 항체를 유도하여 잠재적으로 감염 부위에서 즉각적인 보호를 제공하고 전파를 제한합니다.
mRNA-1273 백신 접종은 S-특이적 CD4 T 세포 반응을 유발합니다
S-특이적 CD4 및 CD8 T 세포 반응은 부스트 2주 후에 평가되었습니다(그림 S5). 용량과 T 헬퍼 유형 1( TH 1) 세포 의 비율 사이에는 직접적인 상관관계가 있었습니다 [인터루킨 2-양성(IL-2 + ), 종양 괴사 인자-양성(TNF + ) 및/또는 인터페론-γ- 양성(IFN-γ + )] 말초혈액 기억 CD4 T 세포( P = 0.006) 중에서 30μg 용량 그룹의 모든 동물이 T H 1 반응을 가졌기 때문입니다 (그림 S6A). 대조적으로, T H 2 반응(IL-4 + 및/또는 IL-5 +)는 모든 백신 용량 그룹에서 낮거나 감지할 수 없었습니다(그림 S6B). 대조적으로, CD8 T 세포 반응은 또한 모든 백신 용량 그룹에서 낮거나 감지할 수 없었습니다(그림 S6E). 2차 림프 기관 내에서 발견되는 T 여포 도우미( TFH ) 세포는 배 중심 내에 위치하기 때문에 B 세포 반응에서 중요한 역할을 합니다. 따라서 우리 는 B 세포를 직접 활성화하여 IgG를 분비하도록 하는 표면 마커 CD40L을 발현하는 S-특이 T FH 세포와 강력한 장기 항체 반응을 개발하는 데 중요한 표준 사이토카인 IL-21로 분석을 확장했습니다. . 대부분의 백신 접종 된 동물은 특정 S-CD40L 나타내 + T FH의 그 크기와 상관 직접 투여 (세포 반응, P를< 0.001) (그림 S6C). 또한 용량과 S-특이적 IL-21 T FH 세포 반응의 크기 사이에 직접적인 상관관계가 있었습니다 ( P = 0.010)(그림 S6D). 따라서, 이전 결과( 13 , 25 , 26 ) 와 일치하여 , mRNA-1273 백신 접종은 T H 1 및 T FH 비스듬한 CD4 T 세포 반응을 유도합니다.
mRNA-1273 백신은 상기도 및 하기도 SARS-CoV-2 복제로부터 보호합니다
보호에 mRNA의-1273 백신 투여의 영향을 평가하기 위해 동물 4 주 8 × 10의 총 복용량 부스트 후 도전 한 5 SARS-COV-2 (USA-의 고병원성 주식의 플라크 형성 단위 (PFU) WA1/2020) 상부 및 하부 기도 감염에 대해 각각 비강 및 기관내 경로를 결합하여 분석합니다(그림 S1C). 챌린지 용량은 SARS-CoV-2 감염 후 인간의 비강 분비물에서 검출된 것과 유사하거나 더 높은 바이러스 부하를 유도하기 위해 선택되었습니다( 27 ). 1차 효능 종말점 분석은 뉴클레오캡시드(N) 유전자에 대한 서브게놈 RNA(sgRNA) 정량적 역전사 중합효소 연쇄 반응을 사용했습니다( 그림 3) N sgRNA는 불연속 전사의 결과로 가장 많이 발현되는 sgRNA 종이기 때문에 다른 NHP SARS-CoV-에서 가장 일반적으로 사용되는 엔벨로프(E) 유전자(그림 S7)( 28 ) 보다 더 큰 감도를 제공합니다. 복제 바이러스를 정량화하기 위한 2개의 백신 연구( 13 ).

그림 3 . 상부 및 하부 호흡기 바이러스 복제에 대한 mRNA-1273의 효능.
( A 및 B ) Rhesus macaques를 그림 1에 설명된 대로 면역화하고 공격했습니다. S1C. BAL(A) 및 비강 면봉(NS)(B)은 접종 후 2일(사각형), 4일(삼각형) 및 7일(다이아몬드)에 수집되었으며 바이러스 복제는 SARS-CoV-2 N-의 검출에 의해 평가되었습니다. 특정 sgRNA. (A)와 (B)에서 상자와 가로 막대는 각각 IQR과 중앙값을 나타냅니다. 수염 끝점은 최대값 및 최소값과 같습니다. ( C 에서 E ) 챌린지 후 2일(C), 4(D) 및 7(E)에 BAL과 NS sgRNA 사이에 표시된 상관 관계는 Spearman의 상관 계수( r ) 및 해당 P 값입니다. 기호는 개별 NHP를 나타내며 겹칠 수 있습니다. 즉, n = (E)에서 BAL 및 NS 모두에 대해 검정 한계(점선)에서 플롯팅된 6마리 동물.
우리는 상기도 및 하기도에서 바이러스 복제에 대한 보호를 위한 백신 용량 효과를 관찰했습니다. 챌린지 후 2일 및 4일 에 각각 1 및 30㎍의 용량에서 대조군 동물과 비교하여 BAL에서 sgRNA_N에서 대략 2 및 5개의 log 10 감소가 있었다( 도 3A ). 더욱이, 챌린지 후 4일까지 1μg 이상으로 백신을 접종한 대부분의 동물은 BAL에서 낮거나 감지할 수 없는 sgRNA_E를 보였습니다(그림 S7A). 대조적으로, 비강 면봉에서 sgRNA의 감소는 대조군 동물과 비교하여 30μg의 mRNA-1273을 받은 동물로 주로 제한되었습니다( 그림 3B).그리고 무화과. S7B). 이러한 데이터는 상부 및 하부 기도 보호를 위한 바이러스 복제 감소에 필요한 면역 반응의 차이를 강조합니다. 바이러스는 비강 면봉 샘플에 비해 BAL에서 더 빨리 제거되었습니다. 상부 및 하부 기도에서 sgRNA 사이의 강한 상관 관계를 관찰했지만, 상부 및 하부 기도 샘플과의 상관 관계에서 시간 의존적 일치의 손실이 있었고( 그림 3, C에서 E ), 이는 바이러스 제거에 대한 별개의 메커니즘을 제안합니다. 두 칸.
mRNA-1273 백신을 접종한 NHP는 제한된 바이러스와 폐 염증을 가지고 있습니다.
각 용량 그룹의 동물은 SARS-CoV-2 공격 7일 또는 8일 후에 폐 및 조직 병리학에서 바이러스의 존재에 대해 평가되었습니다. 대조군 동물에서 SARS-CoV-2 감염은 종종 작은 기도와 인접한 폐포 간질을 침범하는 반점형, 중등도 내지 중증 염증을 일으켰으며, 이는 이전 보고서와 일치합니다( 29 – 31). 폐포 공기 공간은 때때로 염증 세포 침윤물을 포함하고 폐포 모세관 격막은 적당히 두꺼워졌습니다. 더욱이, 중등도 및 미만성 II형 폐세포 증식이 관찰되었다. 대조군의 폐 섹션에 있는 여러 개의 폐세포는 면역조직화학(IHC)에 의해 SARS-CoV-2 바이러스 항원에 대해 양성이었습니다(그림 S8 및 표 S1). 바이러스 항원은 두 대조군 동물 모두에서 검출되었지만 다양한 용량 그룹의 백신 접종 동물에 걸쳐 산발적으로만 검출되었습니다(표 S1). 이러한 관찰은 순진한 NHP가 SARS-CoV-2 감염 후 >1주 후에 폐에서 경미한 염증을 발생시키고 백신 접종이 폐 조직에서 염증 또는 바이러스 항원 검출을 제한하거나 완전히 방지한다는 것을 보여줍니다.
저용량 백신 그룹에서 시험처리 후 기억기억 항체 반응이 증가합니다.
SARS-CoV-2 공격 후 최대 28일 동안 혈액, BAL 및 비강 세척에서 항체 반응을 평가하여 각각 S 또는 N 단백질에 대한 기억상실 또는 1차 반응이 있는지 확인했습니다(그림 S9). 이 분석은 항원공격 후 PCR에 의해 상기도 및 하기도에서 검출된 바이러스가 백신 유도 S-특이적 항체 반응을 증가시키거나 1차 N 반응을 유도하기에 충분한지 여부에 대한 기능적 면역 평가를 제공합니다. 혈청에서, 3, 10 또는 30μg 용량 그룹에서 S-특이성(그림 S9A), RBD-특이성(그림 S9B) 또는 중화 항체(그림 S9C)의 시험처리 후 증가는 없었습니다. 대조적으로, 1μg 미만의 용량에서는 시험감염 전과 비교하여 시험감염 후 28일째에 S-특이성(그림 S9A), RBD-특이적(그림 S9B) 및 중화 항체 반응(그림 S9C)이 증가했습니다. 유사한 1차 S-특이적 항체 반응 경향은 BAL 및 비강 세척 IgG 및 IgA 반응에서도 명백했습니다(그림 S10). 시험처리 전 N-특이적 IgG 반응을 시험처리 후 반응과 비교했을 때, 대조군 동물 및 3㎍ 미만의 mRNA-1273으로 면역화된 동물에서만 혈청전환을 관찰하였다(도 S9D).
폐의 제한된 병리와 결합된 sgRNA에 의해 결정된 바이러스 복제의 감소 및 N에 대한 1차 반응의 유도는 검출할 수 없는 기억 상실증 S 반응 또는 특히 고용량에서 백신 유도 면역 반응이 보호적이었다는 것을 시사하는 세 가지 별개의 측정을 제공합니다. 이것을 더 이해하고 보호 면역의 면역 상관 관계를 설정하기 위해 우리는 다음으로 면역 매개변수와 바이러스 부하 사이의 관계를 조사했습니다.
항체 반응은 SARS-CoV-2 복제에 대한 보호와 상관관계가 있습니다
NHP에서 용량 반응 연구를 수행하기 전에(그림 S1C), 잠재적 상관 관계를 정의하기 위한 분석이 처음에는 비강 면봉(NS)에서 S-특이적 결합 항체와 sgRNA 수준 간의 관계에 초점을 맞출 것이라고 미리 지정했습니다. BAL에서 sgRNA 수준과의 상관관계는 중요한 이차 분석으로 사용되었습니다. 연구의 사전 정의된 1차 가설은 시험감염 시점에 부스트 후 4주째의 S-특이적 IgG가 시험감염 후 2일째 NS에서의 바이러스 복제와 반비례할 것이라는 것이었다. 2차 가설은 부스트 후 4주째의 S-특이적 IgG와 2일째 BAL sgRNA 사이의 관계에 대해 유사했습니다.
단변량(log) 선형 모델을 사용하여 공격 시 S-특이적 IgG는 NS( P = 0.003, 조정된 R 2 = 0.29)( 그림 4G 및 표 S2) 및 BAL( P = 0.001 조정 R 2 = 0.35) ( 도. 4A 날 테이블 S2)가 2. 1 로그 10 S 고유의 변화의 IgG가 맞습니다 1 로그 (10) 에 NS 및 0.9에서 2 일에 sgRNA 변화를 -log 10 제 2 일 (표 S2)에 BAL sgRNA 변화한다. S-특이적 IgG가 sgRNA를 예측하는 다변수 선형 모델에 포함되면 모델에 용량을 포함해도 조정된 R이 실질적으로 증가하지 않았습니다.2 , 또한 계수가 유의하지 않았습니다( NS의 경우 P = 0.115 및 BAL의 경우 P = 0.214). 따라서, NS 및 BAL에서 2일차 sgRNA에 대한 용량 효과는 S-특이적 IgG에 대한 조정에 의해 완전히 포착되는 것으로 보인다. 또한, 이 모델에서 S-특이적 IgG는 NS 및 BAL에서 sgRNA 수준의 상관 관계로 간주되는 사전 지정된 기준을 충족합니다.

그림 4 . 항체는 보호의 상관관계가 있습니다.
히말라야 원숭이를 도 1에 기재된 바와 같이 면역화시키고 시험감염시켰다. S1C. 플롯은 공격 후 2일째 및 공격 전(부스트 후 4주차) SARS 에서 BAL[( A )~( F )] 및 NS[( G )~( L )]에서 SARS-CoV-2 N-특이적 sgRNA 사이의 상관관계를 보여줍니다 . -CoV-2 S-특이적 IgG[(A) 및 (G)], RBD-특이적 IgG[(B) 및 (H)], ACE2-결합 억제[(C) 및 (I)], SARS-CoV- 2 렌티바이러스 기반 슈도바이러스 중화[(D) 및 (J)], SARS-CoV-2 VSV 기반 슈도바이러스 중화[(E) 및 (K)], SARS-CoV-2 EHC-83E 초점 감소 중화[( 바) 및 (라)]. S-특이적 IgG에 대한 회색 음영은 1차 가설에 명시된 바와 같이 보호 결과의 1차 예측인자로 이 평가의 사용을 나타냅니다. ( 남) 시험처리 전(부스트 후 4주차) SARS-CoV-2 S-특이 IgG와 시험처리 후 28일 SARS-CoV-2 N-특이 IgG 사이의 상관관계를 보여주는 플롯. 원은 개별 NHP를 나타내고 색상은 mRNA-1273 용량을 나타냅니다. 점선은 검출의 분석 한계를 나타냅니다. 검은색과 회색 선은 각각 선형 회귀와 95% 신뢰 구간을 나타냅니다. (M)에서 빨간색 점선은 N-결합 역가 6을 나타내며, 이는 모든 그룹에 대한 모든 prechallenge 값의 최대값이며 빨간색 점선 수직선은 500의 역 S-특이적 IgG 역가를 나타내며, 그 이상에서는 동물은 28일째 상호 N-결합 역가가 >6이었다.
RBD-특이적 IgG, ACE2-결합 억제, 슈도바이러스 중화 및 살아있는 바이러스 중화는 모두 S-특이적 IgG와 상관관계가 있기 때문에( 그림 2 ), 우리는 이러한 종점을 sgRNA의 잠재적 상관관계로 분석했습니다. 6개의 항체 측정값 모두는 서로( 도 2 ), 백신 용량( 도 1 )과, BAL( 도 4, A에서 F ) 및 NS( 도 4, G에서 L )의 sgRNA 와 높은 상관관계가 있었습니다 .). 6가지 항체 측정 모두에 대해, 용량은 항체 수준을 조정한 후 BAL의 sgRNA를 유의하게 예측하지 못했습니다(표 S2A). NS의 경우, 투여량은 VSV 기반 의사바이러스 중화에 대해 조정한 후 상당히 예측 가능한 상태로 유지되었고 생 바이러스 중화에 대해 조정한 후에는 미미하게 유의했습니다. S-특이적 IgG 외에도 RBD-특이적 IgG, ACE2-결합 억제 및 렌티바이러스 기반 슈도바이러스 중화는 잠재적인 보호 상관 관계에 대한 우리의 기준을 충족하는 것으로 보입니다. 또한, BAL 및 NS의 하부 및 상부 기도 S-특이적 항체는 각각 BAL(그림 S11, A 및 B) 및 NS sgRNA 수준(그림 S11, C 및 D)과 음의 상관관계가 있습니다.
이러한 발견의 견고성을 평가하기 위해 sgRNA가 BAL의 경우 10,000 sgRNA 사본 및 NS의 경우 100,000 sgRNA 사본으로 정의된 임계값 미만일 확률을 모델링하기 위해 로지스틱 회귀를 사용하여 이러한 분석을 반복했습니다. 이러한 역치는 대조군 동물의 모든 sgRNA 값 아래에 있고 mRNA-1273 백신 접종 동물에 대한 값 범위 내에 있도록 선택되었습니다. 이러한 분석의 결과는 (로그) 선형 모델에서 수행된 1차 분석과 유사했습니다. S-특이적 IgG >336 IU/ml 또는 >645 IU/ml를 갖는 동물은 BAL( 도 4A ) 또는 NS( 도 4G )를 갖지 않았습니다 .) sgRNA는 각각 보호를 정의하는 임계값보다 큽니다(>10,000카피/ml BAL 또는 >100,000카피/면봉 NS). 마지막으로, >488 IU/ml의 S-결합 역가를 갖는 동물은 항원공격 시 배경 값 이상으로 항원공격 후 더 높은 N-특이적 1차 항체 반응을 나타내지 않았다. 이와 일관되게, 시험처리전 S-특이성 항체와 시험처리후 N-특이성 항체 사이에는 강한 음의 상관관계가 있었다( 도 4M ). 또한 BAL에서 10,000 sgRNA 사본/ml 미만인 동물에서 검출된 폐 병리 또는 바이러스 항원이 없는 것으로 제한되어 mRNA-1273 백신 접종 동물이 하기도 질환으로부터 보호된다는 추가 증거를 제공합니다.
우리는 또한 T 세포 반응과 sgRNA 사이의 상관관계를 조사했고 CD40L + T FH 세포 및 T H 1 세포 반응이 각각 BAL 및 NS 모두에서 감소된 sgRNA와 일변량적으로 연관되어 있음을 발견했습니다. S-특이적 IgG에 대한 조정 후, 이들 중 어느 것도 BAL의 sgRNA 수준과 유의하게 연관되어 남아 있지 않았으며, 이는 이러한 T 세포 측정이 BAL에서 측정된 결합 항체와 독립적으로 sgRNA를 예측하지 않는다는 것을 시사합니다. 그러나, IL-21 + T FH , CD40L + T FH 및 T H 1 세포 반응은 NS에서 sgRNA 수준을 상당히 예측하는 것으로 남아 있었다(표 S2B). 따라서 BAL과 NS로부터의 바이러스 제거는 별개의 면역학적 요구사항(도 3, C 내지 E ).
수동적으로 전달된 mRNA-1273에 의해 유도된 IgG는 SARS-CoV-2에 대한 보호를 매개합니다
혈액과 상기도 및 하기도에서의 고역가 항체 반응은 폐의 바이러스 부하 및 하기도 병리의 신속한 제어와 연관되었습니다. 이것은 항체가 보호의 주요 면역학적 메커니즘임을 시사했습니다. 백신 유도 항체가 보호를 매개하기에 충분한지 여부를 직접 다루기 위해 mRNA-1273-면역화된 NHP( 13 )( 그림 5A )의 풀링된 혈청에서 IgG를 정제 하고 수동적으로 햄스터에 전달했습니다( 그림 5B ). 면역 전 IgG 또는 2μg의 mRNA-1273-면역 IgG를 받은 햄스터는 6일째까지 ~10%의 체중 감소를 보였습니다( 32 ). 대조적으로, 10μg의 mRNA-1273-면역 NHP IgG를 받은 햄스터는 공격 후 체중 감소를 거의 또는 전혀 나타내지 않았습니다( 그림 5E). 따라서 mRNA-1273 면역 IgG 단독으로 SARS-CoV-2 감염에 대한 생체 내 질병으로부터의 보호를 매개하기에 충분합니다.

그림 5 . mRNA-1273 면역 NHP IgG의 시리아 햄스터로의 수동 전달.
( A ) 1차 백신접종 시리즈에서 100㎍의 mRNA-1273을 받은 모든 NHP로부터 혈청을 모았다. ( B ) mRNA-1273 면역 NHP IgG(2μg, 노란색, 10μg, 주황색) 또는 면역 전 NHP IgG(10μg, 회색)는 SARS-CoV- 24시간 전에 시리아 햄스터( n = 8/그룹) 로 수동으로 전달되었습니다. 2 도전. ( C 및 D ) 면역화 23시간 후, 햄스터를 채혈하여 순환하는 S-특이 IgG(C) 및 SARS-CoV-2 슈도바이러스 중화 항체(D)를 정량화했습니다. ( E) 공격 후 햄스터의 체중 감소를 모니터링했습니다. (C) 및 (D)에서 원은 개별 NHP를 나타냅니다. 막대와 오차 막대는 각각 GMT와 기하학적 SD를 나타냅니다. 축의 별표는 수동 전달을 통해 적절한 IgG를 받지 못하여 체중 감소 분석에서 제외된 동물을 나타냅니다. (D)에서 점선은 검출의 중화 분석 한계를 나타냅니다. (E)에서 원과 오차 막대는 각각 평균과 SEM을 나타냅니다.
논의
보호의 면역 상관 관계를 정의하는 것은 승인된 백신의 사용을 확대하고, 새로운 후보 백신의 개발을 촉진하고, 잠재적인 보호 메커니즘을 정의하기 위한 백신 개발의 중요한 측면입니다. SARS-CoV-2의 경우 현재 백신의 주요 목표는 증상이 있는 COVID-19를 예방하는 것입니다. 이는 중등도에서 중증 질환을 감소시키는 하기도의 바이러스 부하를 감소시키고 경증 질환을 예방하는 하기도 및 상부 기도의 바이러스 부하를 감소시킴으로써 달성됩니다. 상기도 보호의 또 다른 이점은 바이러스의 비강 운반을 제한하면 전염 위험도 줄일 수 있다는 것입니다. 여기,
NHP에서 보호 상관 관계를 평가하는 주요 매개변수는 공격에 사용되는 바이러스의 양입니다. 이 연구에서 8 × 10 5 PFU의 잘 특성화된 병원성 SARS-CoV-2 USA-WA1/2020 균주를 사용하여 sgRNA( 33 ) 또는 게놈 바이러스 RNA( 34 – 36 )로 측정된 증상 감염이 있는 인간 . 10 6 ~ 10 7 의 N 또는 E에 대한 sgRNA 수준시험감염 후 2일째 대조군 동물에서 NHP 시험감염 연구에 대해 보고된 가장 높은 수치 중 하나이며 접종물 크기의 상단에서 인간의 바이러스 부하를 모델링할 가능성이 있습니다. 우리는 인간 3상 백신 시험에서와 같이 면역 반응을 평가하기 위해 동일한 적격 항체 결합 및 유사 바이러스 중화 분석을 사용했습니다. 또한 WHO 표준을 사용하여 국제 단위로 결합 역가를 보고함으로써 면역 반응 및 결과를 다른 NHP 백신 연구와 비교하고 인간 백신 임상 시험에 대한 벤치마킹을 할 수 있습니다. 우리는 S-결합 역가의 10배 증가가 챌린지 후 BAL 및 NS에서 바이러스 복제의 ~10배 감소와 관련이 있음을 보여주었습니다. S-특이성 IgG가 >336 IU/ml 또는 >645 IU/ml인 동물은 보호를 정의하는 역치(>10, 000개/ml BAL 또는 >100,000개/면봉 NS). 대조군과 비교하여 바이러스 복제의 이러한 감소는 제한된 염증 및 폐 조직의 바이러스 항원 검출과 연관되었으며 중등도 또는 중증의 하기도 감염을 예방하기에 충분한 것으로 나타났습니다. 유도된 S-특이적 항체 수준이 각각 81 및 272 IU/ml이고 상호 슈도바이러스 중화 역가가 각각 49 및 53인 1- 및 3-㎍ 용량 그룹의 동물도 ~2-4를 나타냈다. -통나무챌린지 후 2일째에 대조군 동물과 비교하여 BAL에서 10 적은 바이러스 복제( 34 ). 따라서, 상기도에서보다 하기도에서 바이러스 복제를 감소시키기 위해서는 더 낮은 항체 수준이 필요하다. 더욱이, 이 데이터는 면역 상관관계가 폐의 심각한 질병과 상기도의 경증 감염에 대한 보호를 부여하는 능력에서 어떻게 다를 수 있는지 강조하며, 이는 전염을 제한하기 위해 더 높은 면역 반응이 필요한지 여부와 이것이 추가 부스팅이 필요합니다.
바이러스 복제 감소를 위한 이 고용량 챌린지 NHP 모델에 필요한 항체 역가는 인간의 임상 질환을 예방하는 데 필요한 것에 대한 보수적 추정일 수 있습니다. 적어도 유사한 항원을 전달하는 mRNA 기반 백신에 대해 인간의 보호 상관 관계를 정의하기 위한 기본 측정 기준으로 측정하기 쉬운 결합 역가를 사용하여 혈청 중화 활성 지원과 S-특이 결합 역가 사이의 강한 상관 관계 및 비례 변화 및 유사한 패턴의 면역원성을 유도합니다.
점막 항체 반응은 다양한 상부 호흡기 바이러스 감염에 대한 보호의 중요한 메커니즘으로 생각됩니다( 37 – 41 ). BAL 및 비강 세척 S-특이 IgG 및 IgA는 모두 이러한 구획에서 sgRNA를 감소시키는 것으로 예측되었습니다. 혈청 항체 수준은 BAL 및 비강 세척에서 IgA 및 IgG 반응의 강력한 예측인자일 뿐만 아니라 이러한 부위에서 바이러스 복제에 의해 측정된 보호에 대한 예측인자였습니다. mRNA-1273은 근육내로 투여되기 때문에 국부적인 상부 및 하부 기도 항체가 혈청에서 전달될 수 있으며, 이는 혈청 항체 수준이 mRNA-1273 백신 접종 후 BAL 및 NS 항체 수준에 대한 대리인이 될 수 있음을 시사합니다.
또한 감염이 백신 유도 항체를 증가시킬 수 있는지 여부를 고려했습니다. 시험처리 전과 비교하여 >3-μg 용량 그룹에서 감염 후 28일 이내에 혈액 또는 BAL에서 기생 S-특이 반응 또는 N-특이 반응의 증가가 없었으며, 이는 이러한 용량이 더 높은 항체 반응을 유도하고 바이러스 복제를 방지하는 것과 일치합니다. 대조적으로, <1-μg 용량 그룹에서 증가된 기억기억 S-결합 항체 반응이 있었다. 따라서, 하기도에서 바이러스 복제가 최소인 동물에서 상기도 감염 후에 백신 유도 항체의 부스팅이 발생할 수 있습니다. 따라서 후속 백신 접종의 필요성과 시기는 백신 접종 프로그램의 목표에 달려 있습니다. 한 가지 목표는 심각한 질병과 하기도 감염을 예방하는 동시에 커뮤니티 노출을 허용하여 상기도 감염으로부터 점막 면역을 제공하고 백신 반응을 높이는 것입니다. 또 다른 하나는 백신 접종을 통해 가벼운 감염에 대해 지속적으로 높은 수준의 면역을 달성하여 전염을 더 빠르게 줄이는 것입니다.
현재 순환하는 바이러스 변이체에 대한 보호의 실제 인간 면역 상관 관계를 예측하기 위한 이 연구의 한계가 있습니다. 첫째, NHP의 SARS-CoV2 감염은 상대적으로 폐 병리가 적은 경증의 질병을 모델링합니다. 둘째, 이 연구는 챌린지를 위해 벤치마크 WA-1 균주를 사용했으며 결과는 지속적으로 진화하는 순환 균주 및 변이체로 확장되어야 합니다. 셋째, 면역 반응이 면역 반응의 정점에서 평가되었고, 부스트 후 4주 후에 챌린지가 발생하는 단기 연구였습니다. 따라서 백신 접종 후 더 긴 챌린지 간격을 사용하여 바이러스 감염 또는 질병에 대한 보호에 대한 혈청 항체 수준의 관계는 아직 결정되지 않았습니다.
결론적으로, 이 연구는 NHP 모델에서 SARS-CoV-2에 대한 보호의 상관관계로서 항체의 중요한 역할을 설정하고 mRNA-1273의 경우 S-특이적 결합 항체가 보호의 대리 마커임을 보여줍니다. 진행 중인 NHP 연구는 mRNA-1273 유도 보호의 내구성과 글로벌 SARS-CoV-2 변이체에 대한 mRNA-1273 백신 접종의 효능을 평가할 것입니다. 이러한 발견은 NS에서의 바이러스 복제와 돌발성 감염을 경험한 3상 임상 시험에서 백신 접종 대상의 샘플에 대해 수행된 혈청 항체를 비교하는 상관 분석을 예상합니다.
재료 및 방법
전임상 mRNA-1273 mRNA 및 지질 나노입자 생산
사전융합 안정화 SARS-CoV-2 S-2P 단백질( 2 , 3 )을 인코딩하는 서열 최적화 mRNA 는 시험관 내에서 합성되었고 이전에 보고된 대로 공식화되었습니다( 13 , 25 ).
붉은 털 원숭이 모델
동물 실험은 모든 관련 국립 보건원 규정 및 백신 연구 센터 및 Bioqual Inc.(메릴랜드 록빌)의 동물 관리 및 사용 위원회의 승인에 따라 수행되었습니다. 연구는 Bioqual Inc.에서 수행되었습니다. VRC-20-857.1(그림 S1A)의 실험 세부 정보는 이전에 발표되었습니다( 13). VRC-20-857.3(그림 S1B) 또는 VRC-20-857.4(그림 S1C)의 경우 인도 출신의 3~8년 된 붉은털 원숭이를 성별, 연령 및 체중별로 분류한 다음 그룹으로 계층화했습니다. 동물을 0주 및 4주에 1 ml의 PBS 중 0.3 내지 30 μg 범위의 용량으로 오른쪽 뒷다리에 근육내 면역화시켰다. 위약-대조군 동물에게 동일한 부피의 PBS를 투여하였다. 8주차(부스트 후 4주)에 모든 동물에게 SARS-CoV-2 의 총 용량 8 × 10 5 PFU를 공격했습니다. 1.99 × 10 6 TCID50 또는 3 × 10 6 의 재고PFU/ml SARS-CoV-2 USA-WA1/2020 균주(BEI: NR-70038893)를 기관 내 경로로 3ml 용량으로 희석하고 비강 경로로 1ml 용량(콧구멍당 0.5ml)으로 투여했습니다. . 챌린지 전후 샘플 수집은 그림 1에 자세히 나와 있습니다. S1C.
정제된 IgG를 골든 시리안 햄스터로 수동 전달
VRC-20-857.1에서 100μg의 mRNA-1273으로 면역화된 NHP의 혈청( 13)(그림 S1A)는 부스트 후 2주에 수집되고 풀링되었습니다. 총 IgG는 제조업체의 지침에 따라 Protein G Sepharose 4 Fast Flow 수지(Cytiva)를 사용하여 풀링된 혈청에서 정제하고 NanoDrop OneC Microvolume UV-Vis Spectrophotometer(ThermoFisher Scientific)로 정량화했습니다. 용출된 단백질을 PBS, pH 7.4(Invitrogen)에 대해 투석하고 Amicon Ultra 원심분리 필터(Millipore Sigma-Aldrich)를 사용하여 10 mg/ml로 농축하였다. 6~8주령의 골든 시리안 햄스터는 체중을 기준으로 8마리의 그룹으로 무작위 배정되었으며, 각 그룹은 수컷 대 암컷의 비율이 1:1이었습니다. 2 또는 10 mg의 총 mRNA-1273 면역 IgG는 시험감염 1일 전에 복강내 주사에 의해 수동적으로 전달되었다. 챌린지 직전에 S-특이적 IgG의 평가를 위해 혈청을 수집하였다( 도 5C) 및 중화 역가( 도 5D )를 사용하여 햄스터에서 mRNA-1273 면역 IgG의 상대적인 항체 반응을 확인한다. 햄스터 에 USA-WA1/2020 SARS-CoV-2(BEI, NR-53780)의 3 × 10 4 PFU를 각 콧구멍 사이에 분할된 100μl의 최종 부피로 비강내 접종했습니다 . 챌린지 후 매일 체중 및 임상 관찰이 이루어졌다.
SARS-CoV-2 sgRNA의 정량화
이전에 발표된 방법( 42 )을 사용하여 표본을 처리, 저장하고 서브게놈 SARS-CoV-2 E mRNA를 역전사 중합효소 연쇄 반응(RT-PCR)으로 정량화했습니다. 서브게놈 SARS-CoV-2 N mRNA를 유사하게 정량화하였다(정방향: 5'-CGATCTCTTGTAGATCTGTTCTC-3', 프로브: 5'-FAM-TAACCAGAATGGAGAACGCAGTGGG-BHQ1-3', 역방향: 5'-GGTGAACCAAGACGCAGTAT-3'). 수량화의 하한은 50부였다.
조직병리학과 IHC
이전에 기술한 바와 같이( 13 ), NHP 폐 조직 절편은 일상적인 조직병리학을 위해 헤마톡실린 및 에오신으로, SARS-CoV-2 바이러스 항원 검출을 위해 토끼 다클론 SARS-CoV-2(GeneTex, GTX135357)로 염색되었습니다. 모든 샘플은 보드 인증 수의 병리학자에 의해 평가되었습니다.
4-플렉스 중간 규모 ELISA
MSD SECTOR 플레이트(MSD)는 각 웰에 SARS-CoV 단백질(S-2P, RBD 및 N) 및 소 혈청 알부민 대조군으로 사전 코팅되었고 MSD 차단제 A 용액으로 실온(RT)에서 60분 동안 차단되었습니다. 플레이트를 1x MSD 세척 완충액으로 세척하고 MSD 참조 표준물질(교정기), QC 테스트 샘플(COVID-19 회복기 혈청 풀) 및 열 비활성화 혈청을 연속 희석하고 이중으로 추가했습니다. 참조 표준 및 MSD 대조군 혈청을 희석하지 않고 3회 첨가하였다. 샘플을 1500rpm에서 진탕시키면서 4시간 동안 실온에서 인큐베이션하였다. 세척 후, MSD SULFO-TAG 항-인간 IgG 검출 항체를 실온에서 60분 동안 진탕하면서 첨가하였다. 플레이트를 세척하고 MSD GOLD 판독 완충액을 첨가했습니다. MESO Sector S 600 시스템에서 탐지를 완료하고 MSD Discovery Workbench 소프트웨어 버전 4.0을 사용하여 분석을 수행했습니다.
IU 정의
최근에는 임의의 단위를 WHO 국제표준과 연결하여 환산계수를 계산하여 확인하였다. SARS-CoV 단백질(S-2P, RBD 및 N)에 대해 MSD 참조 표준과 WHO 국제 표준 간의 평행도가 설정되었습니다. 농도 할당을 수행한 다음 MSD와 다중 사이트 확인 연구의 일부로 확인했습니다. 여기에 보고된 샘플 결과는 밀리리터당 국제 단위로 변환되었습니다. S-특이성 IgG는 0.3076 IU/ml의 검출 하한을 가졌다; RBD-특이적 IgG는 1.5936 IU/ml의 검출 하한을 가졌다.
일시적 NHP 혈청 항체 및 햄스터 혈청 항체에 대한 ELISA
혈청 내 SARS-CoV-2 S-특이적 IgG는 ELISA에 의해 정량화되었으며, 사용된 방법은 이전에 발표된 방법과 유사했습니다( 25 ). 여기에서 이전에 발표된 방법론에 대한 유일한 수정 사항은 결과 데이터가 종말점 역가로 표시된다는 것입니다. 이 역가는 GraphPad Prism 버전 9.0.2 소프트웨어를 사용하여 10x SD에 도달한 평균 혈청 역가로 계산되었습니다.
점막 항체 반응을 위한 중간 규모 ELISA
총 S-특이적 IgG 및 IgA는 이전에 설명된 바와 같이 Meso Scale 기술(Meso Scale Discovery, MSD)을 사용하는 다중 어레이 ELISA에 의해 결정되었습니다( 42 ).
혈청 항체 결합력 분석
이전에 설명한 대로 전장 SARS-CoV-2 S-2P 항원에 대한 티오시안산나트륨(NaSCN) 기반 결합력 ELISA를 사용하여 결합력을 평가했습니다. 결합력 지수는 NaSCN의 부재 또는 존재 하에 S-2P에 대한 IgG 결합의 비율을 사용하여 계산하였다. 보고된 결합력 지수는 각각 중복 샘플을 포함하는 두 개의 독립적인 실험의 평균입니다.
ACE2 결합 억제 분석
ACE2 결합 억제는 SARS-CoV-2 RBD로 미리 코팅된 Mesoscale Discovery 384-웰, 4-Spot Custom Serology SECTOR 플레이트를 사용하여 1:40 희석된 혈청 샘플에서 이전에 설명한 대로( 43 ) 완료되었습니다 . 결합은 SULFO-TAGTM로 표시된 ACE2를 사용하여 감지되었습니다. 두 시약 모두 제조업체에서 아낌없이 제공했습니다.
렌티바이러스 슈도바이러스 중화 분석
유사형 렌티바이러스 리포터 바이러스는 D614G 돌연변이, 루시퍼라제 리포터, 렌티바이러스 백본 및 인간 막횡단 프로테아제 세린 2(TMPRSS2) 유전자가 있는 우한-1 균주(GenBank no. MN908947.3)의 S 단백질을 인코딩하는 플라스미드를 HEK293T/17 세포(ATCC CRL-11268)는 이전에 설명된 바와 같습니다( 43 ). 혈청을 이중으로 상대 광 단위에서 루시퍼라제 활성의 정량화에 의해 D614G 슈도바이러스에 대한 중화 활성에 대해 시험하였다. 퍼센트 중화는 감염되지 않은 세포를 100% 중화로 간주하고 슈도바이러스 단독으로 감염된 세포를 0% 중화로 간주하여 정규화하였다. 아이디 50GraphPad Prism 버전 9.0.2 소프트웨어에서 log(작용제) 대 정규화된 응답(가변 기울기) 비선형 회귀 모델을 사용하여 역가를 결정했습니다. 정량의 하한은 1:40 ID 50 이었습니다.
VSV 슈도바이러스 중화 분석
SARS-CoV-2 pseudotyped 재조합 VSV-ΔG-반딧불이 루시퍼라제 바이러스를 만들기 위해 BHK21/WI-2 세포(Kerafast, EH1011)를 D614G 돌연변이가 있는 전장 S를 발현하는 S 플라스미드로 형질감염시킨 후 VSV∆G로 감염시켰다. -반딧불이-루시페라제(이전에 기술된 바와 같이)( 44 ). 중화 분석은 이전에 설명한 대로 연속 희석된 혈청 샘플을 사용하여 A549-ACE2-TMPRSS2 세포에서 완료되었습니다( 16 ). 정량의 하한은 1:40 ID 50 이었습니다.
초점 감소 중화 테스트(FRNT)
VeroE6 세포(ATCC, #CRL-1586)를 배양하고, 바이러스 스톡[EHC-083E(D614G SARS-CoV-2)( 18 ), B.1.1.7(PMID 33739374), 및 B.1.351(PMID 33972938)] 전파되고 적정되었으며 FRNT 분석은 이전에 설명한 대로 수행되었습니다( 45 ). 항체 중화는 Viridot 프로그램( 46). 중화 역가는 다음과 같이 계산되었습니다. 1 - [각 혈청 샘플의 최고 희석액에서 혈청 및 병소가 있는 평균 병소 수의 비율]. 각 표본은 이중으로 테스트되었습니다. FRNT-50 역가는 GraphPad Prism 버전 9.0.2.4.3 소프트웨어에서 4개 매개변수 비선형 회귀를 사용하여 보간되었습니다. 50%의 검출 한계에서 중화되지 않는 샘플은 5로 표시되며 기하 평균 계산에 사용되었습니다.
세포내 사이토카인 염색
백신 접종 후 동결보존된 말초혈액 단핵세포로부터 스파이크 특이적 T 세포 면역 반응의 분석은 이전에 설명한 대로 수행되었습니다( 13 ) . 각 시약에 대한 항체 클론, 접합체, 상용 소스 및 분석 목적은 표 S5에 나와 있습니다. FACS A5 Analyzers(BD Biosciences)에서 데이터를 수집하고 FlowJo 버전 9.9.6 및 10.7 소프트웨어(BD Biosciences)를 사용하여 분석했습니다.
상관 관계 및 통계 분석
그래프는 검출의 분석 한계를 나타내는 점선과 함께 개별 동물의 데이터를 보여줍니다. 항체 측정치 간의 상관관계와 항체 측정치와 백신 용량 간의 상관관계는 Spearman의 비모수적 상관관계를 사용하여 0에 대해 평가되고 테스트되었습니다. 단변량 및 다변량 선형 모델을 사용하여 보호 상관관계로서 항체의 잠재적 역할을 평가했습니다. Prentice 기준에 따름( 47), 우리는 항체 측정이 바이러스 복제의 측정으로서 log10 sgRNA를 유의하게 단변량적으로 예측하는 경우 또는 선형 모델에 log10 용량을 추가해도 가능성 비율 테스트로 평가할 때 예측이 유의하게 개선되지 않은 경우 항체 측정을 보호의 잠재적 상관 관계로 분류했습니다. . 단변량 및 다변량 선형 모델은 또한 sgRNA의 예측에서 T 세포 반응과 항체 반응의 조합을 탐색하는 데 사용되었습니다. 챌린지 전후의 비교는 paired t 테스트를 사용하여 평가 되었으며 마지막 측정을 기반으로 했습니다(가능한 경우 챌린지 후 28일째, 그렇지 않은 경우 14일째). 세포내 사이토카인 가능성이 있는 반응 표지는 MIMOSA를 사용하여 유도되었습니다( 48) 패키지. 분석은 R 버전 4.0.2 및 GraphPad Prism 버전 9.0.2 소프트웨어에서 수행되었습니다.
감사의 말
원고 검토 후 주요 편집에 대해 M. Sriparna에게 감사드립니다. T. Ruckwardt, N. Doria-Rose 및 모든 포함된 실험실의 추가 구성원은 원고에 포함된 실험과 관련된 중요한 토론 및 조언을 제공합니다. J. Stein과 M. Young은 각각 기술 이전 및 행정 지원을 담당했습니다. 동물 실험에 대한 기술 및 행정 지원을 위해 C. Case, H. Bao, E. McCarthy, J. Noor, A. Taylor 및 R. Woodward를 포함한 NIH NIAID VRC Translational Research Program 회원 ACE2-과발현 293 세포에 대한 H. Mu 및 M Farzan; 점막 항체의 검출을 위한 ELISA 분석에 사용하기 위한 단백질을 제공하는 P. Kwong 연구소의 구성원; A. FRNT 분석에 사용된 B.1.351 변이체에 대한 Pekosz; B.1.351 시퀀싱 및 분석 지원을 위해 E. Boritz; 및 M. Brunner 및 M.자금:이 작업은 VRC, NIAID, NIH의 교내 연구 프로그램에 의해 지원되었습니다. 보건복지부, 준비 및 대응 차관보실, 생물의학 첨단 연구개발청, 계약서 75A50120C00034; 학부 장학금 프로그램, 교내 훈련 및 교육실, NIH 소장실(KSC); 미국 에너지부와 NIAID(RW) 간의 기관 간 계약을 통해 Oak Ridge Institute for Science and Education에서 관리하는 NIAID 연구 참여 프로그램; Emory 보건 업무 시너지 펀드 상(MSS) 담당 부사장; 아동 감염 및 백신 및 애틀랜타 아동 건강 관리를 위한 소아 연구 연합 센터(MSS); 및 Woodruff Health Sciences Center 2020 COVID-19 CURE Award(MSS).저자 기여: KSC, MCN, BF, MG, SO, TSJ, SNS, VVE, KF, LL, CM, JF, BF, KW, AC, MK, APW, JIM, OMA, SFA, MMD, JF, DRF, EL , ATN, STN, SJP, AC, AD, AF, JG, SK, LP, MP, KS, DV, SZ, KWB, MM, BMN, RV, HA, KEF, DKE, JRM, INM, MGL, AC, DM , MSS, AM, NJS, MR, DCD, BSG 및 RAS는 실험을 설계, 완료 및/또는 분석했습니다. OMA, SB-B., KL, WS, ESY, YZ 및 LW는 출판된 중요한 시약 및/또는 분석 도구를 제공했습니다. KSC, MCN, NJS, MR, BSG, RAS가 원고를 작성했습니다. KSC, MCN, MG, GA에서 그림과 표를 준비했습니다. 모든 저자는 원고에 대한 토론과 편집에 기여했습니다. 경쟁 관심:KSC와 BSG는 미국 특허 번호 10,960,070 B2 및 국제 특허 출원 번호 WO/2018/081318의 발명가입니다. KSC, OMA 및 BSG는 "2019-nCoV Vaccine"이라는 제목의 미국 특허 출원 번호 62/972,886의 발명가입니다. MSS는 Moderna의 자문 위원회에 있습니다. DV는 Johnson & Johnson과 ABBVIE의 지분을 보유하고 있습니다. 데이터 및 자료 가용성:모든 데이터는 본문 또는 보충 자료에서 사용할 수 있습니다. mRNA1273은 Moderna와의 지역 협력 협약에 따라 제공되었습니다. 이 시약에 대한 액세스를 논의하려면 연구자는 AC 또는 DKE에 문의해야 합니다. 이 작업은 원본 작업이 적절하다면 모든 매체에서 무제한 사용, 배포 및 복제를 허용하는 Creative Commons Attribution 4.0 International(CC BY 4.0) 라이선스에 따라 사용이 허가되었습니다. 인용. 이 라이선스의 사본을 보려면 https://creativecommons.org/licenses/by/4.0/을 방문 하십시오 . 이 라이선스는 제3자에게 크레딧을 제공한 기사에 포함된 그림/사진/아트워크 또는 기타 콘텐츠에는 적용되지 않습니다. 그러한 자료를 사용하기 전에 권리 보유자로부터 승인을 받으십시오.
Immune correlates of protection by mRNA-1273 vaccine against SARS-CoV-2 in nonhuman primates
mRNA-1273 vaccine–induced antibody responses are a mechanistic correlate of protection against SARS-CoV-2 infection in nonhuman primates.
www.science.org
'태국 코로나, COVID-19' 카테고리의 다른 글
| 감염후 ATK 사용 10일의 기록 (0) | 2021.09.20 |
|---|---|
| 태국 코로나, 치앙라이 병원 건설현장 집단 감염 (0) | 2021.09.20 |
| 치앙라이주 2021년 9월 18일 코로나 상황 (0) | 2021.09.18 |
| 바이러스가 몸에 들어오는 경로는 (0) | 2021.09.18 |
| mRNA 백신 접종율 81% 의 싱가폴 사례 (0) | 2021.09.16 |




댓글